カラムなんてしてたら日が暮れる
Complementary Syntheses of N,O-Protected-(S)-2-methylserine on a Multikilogram Scale
http://pubs.acs.org/doi/abs/10.1021/op100299d
- 要約
S1Pモジュレーターの量産検討.見所いっぱいだけど,今回は Boc 化にフォーカスして要約.Boc 化後に残存するBoc2Oをいかに簡便に取り除くか,という課題に対してN-メチルピペラジンを使ってうまく解決している論文.反応後にN-メチルピペラジンを加え,しばらく撹拌すると,余剰分のBoc2Oを消費し対応するN-Boc-N'-メチルピペラジンが生成する.これを抽出で取り除く.
cost : N-メチルピペラジン TCI \12,700/500mL
- メモ
Boc2Oに限らず,様々な酸無水物に対して応用可能だろう.下手にNHシリカのバッチ処理するよりよっぽど早い.過剰にN-メチルピペラジンを使っても,取り除けるので問題ないし非常にエレガントな方法といえる.安いしね.カラム精製を避けたい場合,反応点が複数ある場合などに効力を発揮しそうだ,うまくやれば無水物じゃなくてハライドでも応用できるかも(モノが非水溶性かつ,トラップしたN-アルキル-N-メチルピペラジンが中性〜塩基性でも水にいく場合に限る).問題は,反応の終点(Boc2Oの完全消失点)をどう見極めるか.HPLCではUVが弱くて追いづらいので,時間切りでやるしかないか….実際,彼らは時間切りでやっているしな.
アジンN-オキシド脇にNソース導入
One-Step Conversion of Azine N‐Oxides to α‐N‐Aryltriflamidoazines
pubs.acs.org/doi/abs/10.1021/jo302014c
- 要約

N-アリールトリフルイミドとアジンN-オキシドとからのone-potライゼルト反応.DIPEAを塩基に使い,アセトニトリル溶媒あるいはneatで加温下に実施する.ピリジンN-オキシドの他,ピリミジンN-オキシドやキノリンN-オキシドにも応用できる.但し,電子リッチなアジンを用いたケースではダイメリなどの副反応が進行してしまい,収率は良くない模様.また,イソキノリン,4,6-ジメチルピリミジンのケースでは,様々な位置異性体が競争して複雑になる.
- メモ
かなり苦戦している印象を受けた.求核していくトリフルオロメタンスルホンアミドアニオンの反応性が悪いことに起因しているのだろう.しかし,こんな反応性の低いものがしっかり導入できる点は驚きであるとともに,基質を選択すれば実用に耐えうる反応であると感じた.2-Arylピリジンなんて構造はキナーゼ阻害剤なんかにありがちな構造だから,使ってみてもいいかもな.どうしてもオキシ塩化リンに頼りがちになるものね.
驚くべき反応ですわ
Anomalous Reactivity of Silylborane: Transition-Metal-Free Boryl Substitution of Aryl, Alkenyl, and Alkyl Halides with Silylborane/Alkoxy Base Systems
http://pubs.acs.org/doi/abs/10.1021/ja309578k
- 要約

シリルボランに有機ハロゲン化合物を塩基存在下反応させるとハロゲン-ホウ素置換反応が進行する,という論文.塩基はKOMe,溶媒はDME,ハロゲンはBrが好適の模様.室温付近で進行する.芳香族・脂肪族ハロゲン化物共に反応が進行する.形式的にハロゲン化アリールに対するホウ素アニオンの求核置換反応とみなせるが,メカニズムについての確固たる情報はない.Pdをはじめとする遷移金属が系中に存在しないことを確かめていることから,いわゆる”カップリング反応”ではない模様.また,ラジカル反応でもないことが確認されている.もし芳香族求核置換で進行していることになれば,これは非常に驚くべき反応といえよう.
- メモ
シリルボランと塩基からアート作って求電子剤と反応させる,ってのは最近良く見かけてた.例えば http://pubs.acs.org/doi/abs/10.1021/ja203031a.けれども,どの論文も確かシラン側で優先に反応しC−Si結合を作るって話ばかりで,今回のホウ素側での反応ってのは珍しいんじゃなかろうかな?非常に驚いた.メカニズムが気になります.5配位シリカートなのかなぁ?
光学活性アミンの絶対立体配置決定法
Nanomole-Scale Assignment of Configuration for Primary Amines Using a Kinetic Resolution Strategy
http://pubs.acs.org/doi/abs/10.1021/ja310620c
- 要約

速度論的光学分割を利用した光学活性アミンの絶対立体配置決定法.キラルアシル化剤(R,R)とそれをd化した(S,S)-d3の1:1混合物用意しておき,光学活性アミンにアプライする.得られた混合物のジアステレオマー比をMSの強度比を利用して決定する.この比が1より大きいかどうかで,どちかの立体かが経験的にわかる仕組みになっている.かなり広範な基質に対して成り立つ模様.OHのついた基質はアシル化剤と水素結合するので,通常予想されるとものは逆の立体になるのに注意.

- メモ
d化することによってMSによってジアステレオマーを分離できるようになる一方,反応性はほぼ等しいので単純に立体配置の差だけがアシル化の速度差に効いてくる.目の付け所が素晴らしすぎる.もっともっと基質一般性について調べて欲しい.あとこれ,アミンじゃなくてアルコールにもきっと応用できるはずだよね.そしたらMoscher法よりも素晴らしいと思うよ!
TBD の実力
Demonstration on Pilot-Plant Scale of the Utility of 1,5,7- Triazabicyclo[4.4.0]dec-5-ene (TBD) as a Catalyst in the Efficient Amidation of an Unactivated Methyl Ester
http://pubs.acs.org/doi/abs/10.1021/op300210j
OPRD
- 要約

アシル交換の効果的な触媒として知られる1,5,7-トリアザビシクロ[4.4.0]デカ-5-エン(TBD)を使ったエステルからの直接アミド化.パイロットプラントスケールでのデモンストレーションである.反応はトルエンあるいは2-MeTHF溶媒中で実施.トルエン溶媒でDoE解析を行っており,影響因子は大きい順にTBDの当量および反応温度である模様.主バイプロはエステルの加水分解体およびオキサゾール環が分解して生成するニトリル体.そのため,許容水分量を設定して反応を行っている(target ≦0.10%).TBDが0.3 eq,エステルが1.06 eq.と小過剰.反応温度は68-72℃,反応後晶析処理で粗結晶を得,その後再結晶処理でAPIに導いている.TBDのコストは2,400 USD/kg in 10-kg lots, Aldrich.
- 所感
2006年にHedrickらによってTBDの有用性が見出されて以来,かなり多くの情報が溜まってきたことになる.僕が出ていたゼミでも何度か紹介してもらった記憶がある.短工程化が可能で,なおかつルイス酸使用や超強熱条件を避けることができ,除きやすい.水を嫌うようなので扱いづらさはあると思うが,プロセス向きな反応と言える.原料となるエステルが結晶で用意できれば水の問題もさほど気にならないだろう.積極的に使って行きたい.気になるTBDの高活性の要因については, J. Org. Chem. 2009, 74, 9490–9496 に述べられているが,掻い摘むと,
- プロトンドナーアクセプター構造になっているので,カルボニル基を活性化し且つその反応点近くにアルコールまたはアミンをおびき寄せることができる(酵素反応likeっていうのか,エントロピー的に有利ってことっすかね).
- ”ツイストアミド”構造.つまり,活性中間体であるアシル化TBD(ATBD)が,平面構造を取れず少し歪んでいるがために安定性を失い,高活性になっている.
この2点が肝である模様.


すなわち,”ツイストアミド”が重要なわけだから,ちょっと員環数が異なるグアニジン誘導体を持ってきても活性は見込めないってことなんだろうな.TBD ピンポイントであることに注意したい.限られた時間で条件ふる時はTBDがダメならグアニジン系はあんまり粘らずにサッサと諦めるようにしようかね.
芳香環のモノフルオロメチル化
- 要約

(2-ピリジル)スルホニル基を隣接基に持つフルオロメタンからCu試薬を調製し,芳香族ヨージドとのクロスカップリングにより対応するモノフルオロメチルアレーンを合成する,という論文.これまでCuを使ったクロスカップリングで方向環をCF3化,CHF2化したってのは良く知られているけれど,CH2F化は殆どなかった.対応するCu試薬が不安定であるためと考えられている.今回,隣接基に(2-ピリジル)スルホニル基を導入することにより,調製したCu試薬の安定性,反応性が向上し,広範な基質においてモノフルオロメチル化(Bu3SnH処理後)を達成している.尚,Cu試薬はスルホンのα位にNISでヨウ素を導入後,Znを挿入しCuIとトランスメタル化して調製する.CuIは触媒量でも可.隣接基のArはピリジル基の他に,BTやTBTも試みているがイマイチのようだ.
広範な基質で使用可能だ.電子の押し・引き,複素環にかかわらず,あらゆるシーンで中程度の収率を叩き出せる模様.スルホンの魅力を最大限に発揮してJulia Kochienski反応に展開しているケースなどもあり実用的な反応だ.
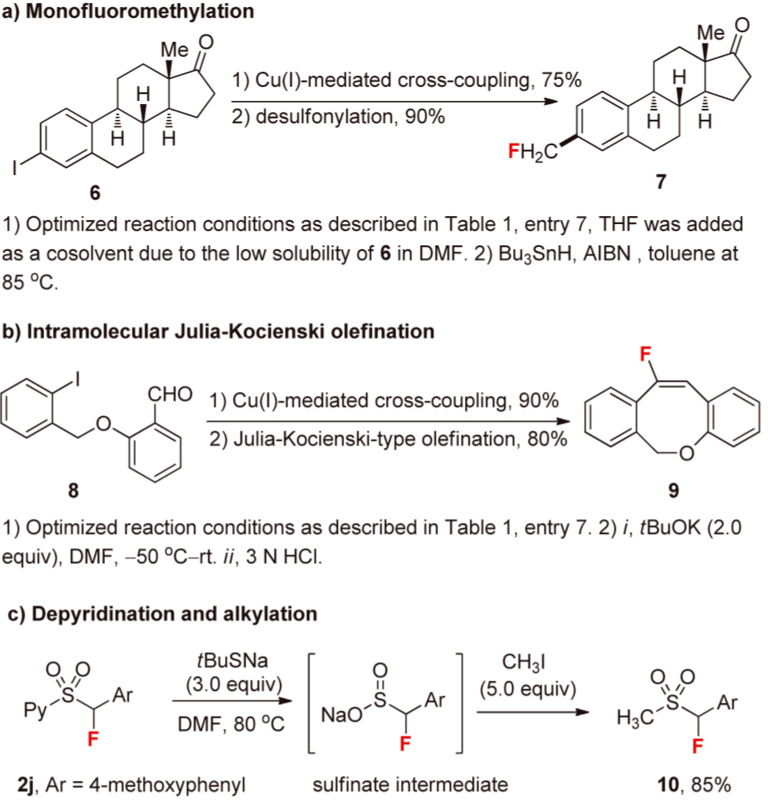
- 所感
CF3化についてはわんさか反応が知られているけれど,CH2F化はなかなか見かけなかったな.数少ない合成法しかない土壌で選択肢が増えたことは無上の喜びである.まあこれならアルコールからつくることもできるけどね.
ただ,基本的にF基を入れるのは非常にコストがかかる作業だ.また,F化試薬は腐食性が高くて特殊反応釜を使用しなければならいことが多く外注に頼りがちになり外注先をコントロールしていくのに苦労する.その上,最近はGTI(遺伝毒性不純物Genotoxic Impurity)の問題がある.APIにおいてppmオーダーでの厳密な含有量のコントロールをしなけりゃならない不純物だ.F試薬にはほぼ必ずといっていい程対応するCl試薬が含まれているので,微量とはいえ基質にCl原子が導入されてしまう.芳香族ならばさほど問題にならないかもしれないが,脂肪族のCl体はいわばアルキル化剤なのでAmesポジのリスクは格段に上がる.これがポジになれば晴れてGTIに認定され厳格なコントロールを余儀なくされる.コスト面から考えるとF化工程を合成スキームの終盤に持ってきたいところだが,F化物とCl化物を効率良く分離するのは容易ではない.そう考えると前半に持ってきたい.でもコストは跳ね上がる.シーソーゲームである.まだ日本ではGTIについてのガイドラインははっきりしていない.でも近い将来,GTIは必ずつきまとうことになるだろう.不斉の化合物を取り扱うよりも大きな労力を要するように思う.それでも尚フッ素を入れたほうが魅力的なキャラクターなのかどうか .フッ素デザインは慎重に行っていきたい.
三員環歪み利用して N-アミノ化
N-Silyloxaziridines : Synthesis and Use for Electrophilic Amination
J. Org.Chem. ASAP
- 要約

N-シリルオキサジリジンを求電子的アミノ化剤として用いてヒドラジン誘導体を合成する,という論文.N-置換オキサジリジン類はかつてから合成化学に利用されてきたけれど,N-シリルになったやつは業界初のお目見え.オキサジリジン類は基本的に求電子剤として働く.N上の置換基によって異なる反応になり,酸素原子上で反応するケースと窒素原子上で反応するケースに大別される.ほとんどのケースでは酸素側だが,今回はめずらしく窒素側で反応するようだ.マイノリティ万歳.
本論文の実施例では,反応の相手は第一アミン,第二アミン,第二アミドが用いられており,対応するヒドラジン誘導体を合成している.この他,低収率ながらメルカプタンとも反応してN-S結合生成を行いスルフェナミドを合成することもできるようだ.一方,スチルベンやマレイン酸エステルを反応させてN-C結合生成も試みているが,これはうまくいってない.なお,オキサジリジン側のArには電子吸引基がついている方が調子が良い模様(4-ニトロフェニル>フェニル).
反応機構は次の通り.オキサジリジンに対するアミンの求核攻撃がfirst step.その後N-O結合を切断するように開環し,塩基性条件下でのピーターソン反応のような電子移動を経て,目的とするヒドラゾン誘導体が得られる.この機構はオキサジリジンのNがウレタン保護された基質を用いるケースとは全く異なるようだ.ちなみにウレタン保護では,アミンの求核攻撃の後に三員環がアルデヒドとヒドラジン誘導体に分解する段階を経る.これらが互いに反応してヒドラジン誘導体が得られるとされている.β位に酸素ファンクションを持つケイ素は面白いね.

- 所感
ヒドラジン誘導体は複素環を作るには欠かせない存在だ.インドールになるし,ピラゾールもいけるし,ピリダジンもいけるし,ピロールだって作れる.このような重要性にも関わらず,売っているヒドラジン誘導体は少ない.この論文はその手助けになってくれるかもな.ただ実際の現場を考えた時,必要となるのはもっぱらRNHNH2という形の一置換ヒドラジンであろう.今回得られるのはあくまでヒドラゾン.利用するにはヒドラゾンの加水分解がうまくいくかどうかにかかっているな.そういう意味では,最近報告されたT. Baburaja, S. Thambidurai, Synlett, 2011, 1993-1996. の方が馴染みやすいかもしない.あるいは,カップリングでN-置換ヒドラジン作るっていう手もある.またあるいは,一度N-無置換の複素環を構築しておき,あとでカップリングorアルキル化するっていう手もあるよね.うーんこの論文は,オキサジリジンの窒素原子上で反応が行くという点と,ピーターソン反応様の反応機構,というところは非常に興味深いのだけれども,ヒドラジン合成としての利用価値は微妙かな.
それならばオレフィンとは反応しないっていうほどのマイルドな反応性を逆に活かして,アミンスカベンジャーとして利用するのはどうだろうか.中性条件下にアセニト中,混ぜるだで進行するという点は大きなアドバンテージだ.副生するのも,シラノールだから悪さしないし,除きやすいよね.それと,カルバニオンを反応させて欲しかった.うまくやってN-C結合作ってイミンが得られれば,加水分解でアミンが取れる.マロネートからアミノ酸合成とかね.